Несмотря на прогресс в лечении шизофрении, она остается одной из ведущих причин инвалидности во всем мире.
Ограниченная эффективность антипсихотического лечения усугубляет бремя шизофрении. Крупный метаанализ показал, что только 23% пациентов, участвовавших в клинических исследованиях шизофрении, имели хороший ответ, что определяется снижением симптомов на 50% или более по Краткой психиатрической рейтинговой шкале/оценке положительных и отрицательных симптомов (BPRS/PANSS). ), и это было лишь примерно на 10% лучше, чем уровень ответа на плацебо.
С момента открытия антипсихотического действия хлорпромазина все лекарства, одобренные Управлением по контролю за продуктами и лекарствами для лечения симптомов шизофрении, блокировали действие дофамина на D2-рецепторы. Это имеет смысл, поскольку повышенное высвобождение дофамина в передне-дорсальном «ассоциативном» полосатом теле, связанное с шизофренией, способствует развитию психотических симптомов. Захват этих D2-рецепторов антагонистами D2-рецепторов нормализует уровень их дофаминергической стимуляции.
Однако степень, в которой симптомы шизофрении связаны с гиперактивностью дофамина, варьируется у разных пациентов, и в биологии шизофрении задействованы многие другие механизмы, которые нельзя устранить с помощью блокады D2-рецепторов.
Это захватывающий момент в исследованиях шизофрении: новые взгляды на биологию шизофрении сходятся с новыми лекарствами, нацеленными на новые механизмы мозга, которые могут лечить симптомы, не блокируя рецептор D2. Эта статья начнется с обзора этих многообещающих новых лекарств, а затем предложит общую схему развития нервной системы, которая поддерживает исследование этих новых механизмов лечения.
Нацеленность на глутамат
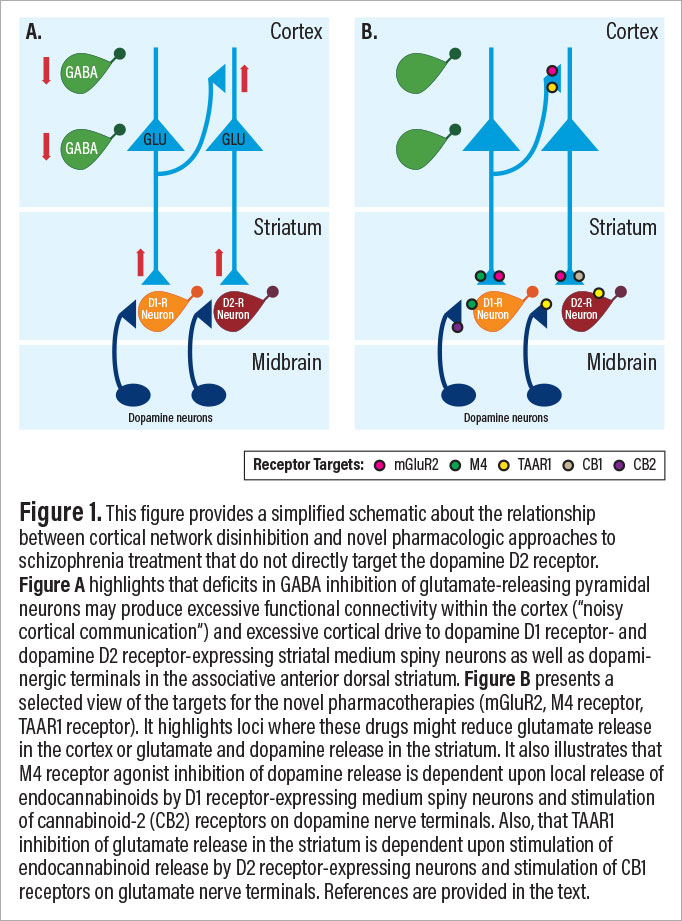
Несколько лекарств, которые в настоящее время или ранее находятся в стадии разработки, направлены на устранение синаптического дефицита глутамата, который может быть самым ранним первичным фактором патофизиологии шизофрении. Механизмы, рассмотренные ниже, включают ингибирование переносчика глицина-1 (GlyT1), стимуляцию метаботропного глутаматного рецептора-2 (mGluR2), стимуляцию мускариновых рецепторов M4 и стимуляцию рецептора 1, связанного с следами аминов (TAAR1). Как будет рассмотрено ниже, стимуляция рецепторов mGluR2, M4 и TAAR1 обладает общей способностью снижать высвобождение дофамина в полосатом теле и высвобождение кортико-стриарного глутамата посредством механизмов, представленных на рисунке 1.
Было проведено обширное тестирование стратегий усиления стимуляции участка коагониста глицина глутаматного рецептора N-метил-D-аспартата (NMDA). В исследованиях оценивались агонисты аминокислот (глицин, D-серин, D-аланин), частичный агонист модифицированных аминокислот (D-циклосерин), блокирующий поглощение глицина (GlyT1), блокирующий поглощение D-серина (ASCT1), и ингибирование фермента, который метаболизирует D-серин (оксидаза D-аминокислот, DAO). В целом, эти вещества либо не были должным образом оценены, либо они не продемонстрировали достаточного клинического улучшения, чтобы привести к одобренным FDA клиническим показаниям.
Однако одно многообещающее недавнее открытие показало, что ингибиторы GlyT1 могут уменьшить дефицит нейропластичности, связанный с шизофренией. Хотя ингибитор GlyT компании «Рош», бипертин, не продемонстрировал эффективности в исследованиях фазы 3 после получения многообещающих результатов в фазе 2, недавнее исследование с ингибитором GlyT1 BI425809 обнаружило многообещающее влияние на когнитивные нарушения. В этом 12-недельном исследовании (n = 509, примерно 85 пациентов в группе) сообщалось о дозозависимом улучшении производительности Матричной консенсусной когнитивной батареи, в частности об улучшении скорости обработки данных, измеренной с помощью задачи «Прокладывание маршрута», но не было существенных изменений в симптомах. Они также предположили, что улучшения были более значительными у пациентов, не принимавших бензодиазепины. Однако исследования ингибиторов GlyT1 еще не проводились у пациентов с продромальным периодом или ранним течением заболевания, групп, для которых модель, связанная с фазой заболевания, могла бы предсказать пользу. Единственные данные на сегодняшний день получены из многообещающего открытого исследования глицина, показывающего уменьшение симптомов у пациентов с продромальными симптомами у пациентов из группы сверхвысокого риска.
Вероятно, первым новым препаратом, который продемонстрировал эффективность в снижении психоза при шизофрении без блокирования D2-рецепторов, был агонист метаботропных глутаматных рецепторов 2/3 (mGlur2/3) LY2140023, пролекарство LY404039. Рецепторы mGluR2 служат одновременно ингибирующими ауто- и гетерорецепторами глутамата, при этом агонисты mGluR2 ингибируют высвобождение глутамата в коре головного мозга и полосатом теле, и где эти препараты вторично ингибируют высвобождение дофамина (см. Рисунок 1B). После первоначального положительного исследования в качестве монотерапии шизофрении последующие исследования не показали эффективности. Однако вторичный анализ показал, что LY21340023 был полезен на ранних стадиях заболевания, когда преобладает кортикальная функциональная гиперсвязность, и был неэффективен или даже ухудшал симптомы при хроническом заболевании, когда дефицит функциональной связи, связанный с синаптическими потерями, может усугубляться агонизмом mGluR2/3. . Таким образом, хотя агонисты mGluR2/3, возможно, не обладают общей эффективностью при симптомах шизофрении, однажды они могут сыграть лечебную роль в рамках стратегии точной медицины.
Многообещающие результаты двух недавних клинических исследований фазы 2 выявили две инновационные стратегии лечения симптомов шизофрении без блокирования рецепторов D2: стимуляция мускариновых рецепторов M1/M4 и агонизм TAAR1. Уже давно существует интерес к терапевтической роли агонизма рецепторов М4 после клозапина, его метаболита десметилклозапина и ксаномелина. Было показано, что все они проявляют агонистическую или частичную агонистическую активность М4. Хотя терапевтические эффекты клозапина хорошо известны, пилотное исследование ксаномелина и совсем недавно более масштабное исследование ксаномелина-тропсия (n=90, плацебо n=92), сочетающее ксаномелин и антагонист периферических мускариновых рецепторов, было направлено на улучшение переносимости ксаномелина (троспия). ) продемонстрировали доказательства эффективности в отношении положительных и отрицательных симптомов. Агонист TAAR1 и 5HT1A, SEP-363856, также продемонстрировал эффективность в качестве монотерапии как для положительных, так и для отрицательных симптомов, связанных с шизофренией, в крупном исследовании фазы 2 SEP-363856 (n=125, плацебо n=120).
Предполагается, что эти новые антипсихотические препараты вызывают клиническое улучшение как за счет дофаминергических, так и глутаматергических механизмов (см. Рисунок 1B). Например, сообщается, что как агонисты M4, так и агонисты TAAR1 снижают высвобождение дофамина. Как уже отмечалось, агонисты М4, по-видимому, уменьшают высвобождение дофамина, стимулируя рецепторы М4, расположенные на средних шипистых нейронах (MSN), несущих рецептор дофамина-1, в полосатом теле, которые являются постсинаптическими по отношению к проекциям дофамина. Стимуляция рецептора М4 в этих MSN вызывает высвобождение эндоканнабиноидов, особенно 2-AG. Затем 2-AG обратно диффундирует через синапс, стимулируя каннабиноидные рецепторы CB2 и подавляя высвобождение дофамина. Рецепторы М4 также расположены на некоторых других клеточных элементах полосатого тела, включая холинергические интернейроны и глутаматергические окончания аксонов нейронов, выступающих из коры и таламуса.
Агонизм TAAR1 ингибирует высвобождение дофамина в полосатом теле посредством нескольких механизмов. TAAR1 может совместно локализоваться с дофаминовыми рецепторами D2, образовывать гетеродимеры D2-TAAR1 и способствовать ингибированию ауторецепторами D2 высвобождения дофамина. Облегчение TAAR1 функции рецептора D2 также вызывает высвобождение эндоканнабиноидов из MSN и стимуляцию каннабиноидных рецепторов CB1 в корковых проекциях полосатого тела, ингибируя высвобождение глутамата. Кроме того, TAAR1 присутствует в пирамидных нейронах слоя V в префронтальной коре (PFC), где он может влиять на баланс передачи сигналов глутаматных рецепторов AMPA и NMDA и эффекты, связанные со стрессом буфера, на функцию PFC.
Нацеливание лекарств на стадии заболевания
Считается, что все три новых лекарства, которые уменьшают психоз, не блокируя дофаминовые D2-рецепторы, уменьшают высвобождение дофамина и глутамата в кортико-стриатальных цепях (см. Рисунок 1B). Это представляет собой поразительную механистическую конвергенцию на уровне схемы. Ранее мы предположили, что нейробиология шизофрении развивается в течение жизни человека и что могут быть разработаны лекарства, нацеленные на определенные фазы заболевания.
Эта модель предполагает, что дефицит глутаматных синапсов присутствует пренатально и что он ставит под угрозу развитие и поддержание интернейронов ГАМК. В подростковом возрасте возникающий дефицит передачи сигналов ГАМК растормаживает кортикальные сети, вызывая корковую функциональную гиперсвязность, шумную корковую обработку информации, менее точные кортикальные представления информации и гиперактивность корковых проекций на полосатое тело, что способствует дорсальной стриарной дофаминергической гиперактивности, которая связанный с психозом (см. рисунок 1А). Мы полагаем, что при хронической шизофрении растормаживание сети вызывает гомеостатическое подавление синаптической структуры и функции глутамата, что усугубляет влияние запрограммированной синаптической элиминации и других механизмов, посредством которых синаптическая элиминация может быть ускорена при шизофрении, таких как усиленная экспрессия комплемента C4A.
В этой модели подразумевается, что по мере развития патология шизофрении не только прогрессирует, но и становится более сложной; это затрудняет лечение всего спектра симптомов шизофрении с помощью отдельных препаратов. Ключевое терапевтическое значение этой модели, которая предполагает как прогрессирующую, так и все более сложную патофизиологию, заключается в том, что данное лечение, вероятно, окажет наибольшее влияние на самой ранней стадии заболевания, когда выражены соответствующие механизмы, на которые направлено это лечение. Например, определенное лечение, такое как агонист mGluR2, может быть эффективным на ранних стадиях заболевания, когда оно компенсирует дефицит коркового торможения, но оно может потерять эффективность по мере прогрессирования заболевания, и тот же препарат теперь усугубляет воздействие синаптического торможения. дефицит
Таким образом, в настоящее время изучаются как минимум четыре новых многообещающих лекарства для лечения шизофрении. Тот факт, что три из этих новых препаратов ингибируют высвобождение глутамата и дофамина, привлекает наше внимание к патофизиологическим моделям шизофрении, которые включают избыточное высвобождение глутамата и дофамина. Рассмотренная здесь модель предполагает, что избыточное высвобождение глутамата и дофамина возникает в состоянии высокого риска и сохраняется на протяжении всего раннего течения шизофрении.
На более поздних стадиях заболевания потеря синапсов усложняет как биологию, так и лечение этого заболевания. Этот подход к фармакотерапии, зависящий от фазы заболевания, является основой для повышения точности фармакотерапии шизофрении. Однако предложенная модель развития является общей, и мы признаем, что существуют важные различия в биологии шизофрении у разных пациентов, которые могут объяснить, почему отдельный пациент может не соответствовать этой модели. Описанный выше подход был бы более эффективным, если бы он основывался на биомаркерах функции контура у отдельных пациентов. Этот тип подхода, основанного на биомаркерах, может привести к еще более точному сопоставлению ингибирующего лечения с признаками растормаживания сети или дофаминергической гиперактивности у отдельных пациентов. Например, геномные биомаркеры могут также стимулировать разработку новых терапевтических средств, особенно для пациентов со специфическими редкими мутациями потери функции, которые приводят к значительному увеличению заболеваемости шизофренией. Если бы людей с этими мутациями можно было идентифицировать как можно раньше, это создало бы возможность назначить специфическое медикаментозное лечение или генную терапию задолго до появления психотических симптомов. Как это часто случается в психиатрии, открытие фармакотерапии, работающей через новые механизмы, фокусирует наше внимание на новых аспектах биологии и новых возможностях лечения этого расстройства.
Эта работа поддержана UO1 MH121766-01. ■
Ссылки
1.
Ф. Дж. Чарльсон, А. Дж. Феррари, Д. Ф. Сантомауро, С. Диминик, Э. Стокингс, Дж. Г. Скотт, Дж. Дж. МакГрат, Х. А. Уайтфорд, Глобальная эпидемиология и бремя шизофрении: результаты исследования глобального бремени болезней, 2016 г., Schizophr Bull 44(6) ( 2018) 1195-1203.
2.
С. Лойхт, К. Лойхт, М. Хун, А. Чаймани, Д. Мавридис, Б. Хелфер, М. Самара, М. Рабайоли, С. Бэхер, А. Чиприани, Дж. Р. Геддес, Г. Саланти, Дж. М. Дэвис, Шестьдесят лет плацебо-контролируемых исследований антипсихотических препаратов при острой шизофрении: систематический обзор, байесовский метаанализ и метарегрессия предикторов эффективности, Am J Psychiatry 174(10) (2017) 927-942.
3.
Дж. Дж. Вайнштейн, М. О. Чохан, М. Слифштейн, Л. С. Кегелес, Х. Мур, А. Аби-Даргам, Специфические нарушения дофамина при шизофрении, Biol Psychiatry 81 (1) (2017) 31-42.
4.
М. Ларуэль, А. Аби-Даргам, Дофамин как ветер психотического огня: новые данные исследований визуализации мозга, Журнал психофармакологии . 13(4) (1999) 358-71.
5.
Дж. Х. Кристал, А. Антицевич, Фармакотерапия шизофрении в зависимости от фазы заболевания, Biol Psychiatry 78 (11) (2015) 738-40.
6.
Р. Р. Гиргис, А. В. Зогби, Д. К. Джавитт, Дж. А. Либерман, Прошлое и будущее новых методов лечения шизофрении с помощью рецепторов, не содержащих дофамина-2: критический и всесторонний обзор, J Psychiatr Res 108 (2019) 57-83.
7.
Д.Суза, Р.Э. Карсон, Н. Дрисен, Дж. Йоханнесен, М. Ранганатан, Дж. Х. Кристал, Занятость мишени в зависимости от дозы и влияние на схемы, поведение и нейропластичность ингибитора транспортера глицина-1 PF-03463275 у здоровых и здоровых людей. Субъекты шизофрении, Биологическая психиатрия 84(6) (2018) 413-421.
8.
В. В. Фляйшхакер, Дж. Подхорна, М. Грёшль, С. Хейк, Ю. Чжао, С. Хуанг, Р.С.Э. Киф, М. Деш, Р. Бреннер, Д.П. Уоллинг, Э. Мантеро-Атьенца, К. Накагоме, С. Поллентье , Эффективность и безопасность нового ингибитора переносчика глицина BI 425809 один раз в день у пациентов с шизофренией: двойное слепое рандомизированное плацебо-контролируемое исследование фазы 2, The Lancet. Психиатрия 8(3) (2021) 191-201.
9.
С.В. Вудс, Б.К. Уолш, К.А. Хокинс, Т.Дж. Миллер, Дж.Р. Сакса, Д.С. Д'Суза, Г.Д. Перлсон, Д.С. Джавитт, Т.Х. МакГлашан, Дж.Х. Кристал, Лечение глицином синдрома риска психоза: отчет о двух пилотных исследованиях, Европейская нейропсихофармакология: журнал Европейского колледжа нейропсихофармакологии 23(8) (2013) 931-40.
10.
Б. Дж. Кинон, Б. А. Миллен, Л. Чжан, Д. Л. МакКинзи, Исследовательский анализ целевой популяции пациентов, реагирующих на агонист метаботропных рецепторов глутамата 2/3 помаглуметад метионил при шизофрении, Биологическая психиатрия (2015).
11.
К. А. Джонсон, Ю. Матео, Д. М. Ловинджер, Метаботропный глутаматный рецептор 2 ингибирует высвобождение глутамата и дофамина, обусловленное таламизмом, в дорсальном полосатом теле, Neuropharmacology 117 (2017) 114-123.
12.
А. Л. Персон, Б. Могаддам, Влияние стимуляции метаботропных рецепторов глутамата 2/3 на активированное высвобождение дофамина и передвижение, Psychopharmacology (Berl) 211 (4) (2010) 443-55.
13.
Патил С.Т., Чжан Л., Мартеньи Ф., Лоу С.Л., Джексон К.А., Андреев Б.В., Аведисова А.С., Барденштейн Л.М., Гурович И.Ю., Морозова М.А., Мосолов С.Н., Незнанов Н.Г., Резник А.М., Смулевич А.Б., Точилов В.А., Джонсон Б.Г. Дж. А. Монн, Д. Д. Шёпп, Активация рецепторов mGlu2/3 как новый подход к лечению шизофрении: рандомизированное клиническое исследование фазы 2, Nat Med 13 (9) (2007) 1102-7.
14.
XP Zeng, F. Le, E. Richelson, Активация мускариновых рецепторов m4 некоторыми атипичными антипсихотическими препаратами, Eur J Pharmacol 321(3) (1997) 349-54.
15.
С. Жигу, С. Виршке, К. Денике, Р. А. Дайс, Различная фармакология N-десметилклозапина на mAChR человека и крысы M2 и M 4 в неокортексе, Naunyn Schmiedebergs Arch Pharmacol 388(5) (2015) 487-96.
16.
С. К. Браннан, С. Савчак, А. С. Миллер, Дж. А. Либерман, С. М. Пол, А. Брейер, Агонист мускариновых холинергических рецепторов и периферический антагонист шизофрении, N Engl J Med 384 (8) (2021) 717-726.
17.
К.С. Коблан, Дж. Кент, С.С. Хопкинс, Дж. Х. Кристал, Х. Ченг, Р. Голдман, А. Лебель, Препарат, не связывающий D2-рецептор, для лечения шизофрении, N Engl J Med 382 (16) (2020 г.) ) 1497-1506.
18
М. С. Моул, П. Дж. Конн, Роль рецептора ацетилхолина M (4) в базальных ганглиях и лечение двигательных расстройств, Mov Disord 34 (8) (2019) 1089-1099.
19.
Ю. Пей, А. Асиф-Малик, Дж. Дж. Каналес, Следовые амины и рецептор, связанный с следовыми аминами 1: фармакология, нейрохимия и клинические последствия, Frontiers in Neuroscience 10 (2016) 148.
20
А. Альварссон, К. Чжан, Т. Л. Стэн, Н. Шинту, Б. Кадходаи, М. Дж. Миллан, Т. Перлманн, П. Свеннингссон, Модуляция с помощью следового аминоассоциированного рецептора 1 экспериментального паркинсонизма, чувствительности к L-ДОФА и глутаматергической нейротрансмиссии , J Neurosci 35(41) (2015) 14057-69.
21.
С. Эспиноза, Г. Линьяни, Л. Каффино, С. Магги, И. Суханов, Д. Лео, Л. Мюс, М. Эмануэле, Г. Ронзитти, А. Хармайер, Л. Медрихан, Т. Д. Сотникова, Э. Кьерегатти , MC Hoener, F. Benfenati, V. Tucci, F. Fumagalli, RR Gainetdinov, TAAR1 модулирует функцию кортикального глутаматного рецептора NMDA, Neuropsychopharmacology 40(9) (2015) 2217-27.
22.
Ю. Чжан, Дж. Т. Ли, Х. Ван, В. П. Ню, К. С. Чжан, Ю. Чжан, К. Д. Ван, Т. М. Си, Ю. А. Су, Роль следового аминоассоциированного рецептора 1 в медиальной префронтальной коре при хроническом когнитивном дефиците, вызванном социальным стрессом на мышах, Pharmacol Res 167 (2021) 105571.
23.
Дж. Х. Кристал, А. Антицевич, Г. Дж. Ян, Г. Драгой, Н. Р. Дрисен, К. Дж. Ван, Дж. Д. Мюррей, Нарушение настройки нейронных ансамблей и патофизиология шизофрении: перспектива трансляционной и вычислительной нейронауки, Biol Psychiatry 81 (10) (2017) 874-885.
24
А. Секар, А. Р. Биалас, Х. де Ривера, А. Дэвис, Т. Р. Хаммонд, Н. Камитаки, К. Тули, Дж. Презуми, М. Баум, В. Ван Дорен, Г. Дженовезе, С. А. Роуз, Р. Е. Рукосакер, М. Дж. Дейли, М. К. Кэрролл, Б. Стивенс, С. А. МакКэрролл, Риск шизофрении из-за сложных вариаций компонента 4 комплемента, Nature 530 (7589) (2016) 177-83.
25.
Т. Сингх, Дж. Т. Уолтерс, М. Джонстон, Д. Кертис, Дж. Сувисаари, М. Торниайнен, Э. Рис, К. Айегбе, Д. Блэквуд, А. М. Макинтош, Г. Киров, Д. Гешвинд, Р. М. Мюррей, М. Ди Форти, Э. Брамон, М. Гэндал, К. М. Хультман, П. Склар, А. Палоти, П. Ф. Салливан, М. К. О'Донован, М. Дж. Оуэн, Дж. К. Барретт, Вклад редких вариантов в риск шизофрении у людей с шизофренией и без нее. умственная отсталость, Nat Genet 49(8) (2017) 1167-1173.
26.
С. Э. Легге, М. Л. Санторо, С. Периясами, А. Океволе, А. Арсалан, К. Ковалек, Генетическая архитектура шизофрении: обзор основных достижений, Psychol Med (2021) 1-10.
Заявление о раскрытии информации Джона Х. Кристала, доктора медицинских наук
Перечисленные ниже соглашения с индивидуальными консультантами стоят менее 10 000 долларов США в год.
Aptinyx, Atai Life Sciences, AstraZeneca Pharmaceuticals, Biogen, Idec, MA, Biomedisyn Corporation, Binomics, Limited (Австралия), Boehringer Ingelheim International, Cadent Therapeutics, Clexio Bioscience, Ltd., COMPASS Pathway





